Строение h2co3. Химическая формула H2CO3 Вид молекулы Общие сведения Угольная кислота́ слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах
Неорганические кислоты имеют очень важное значение в химической промышленности. Ведь они являются сырьем для многих синтезов, катализируют процессы, действуют как водоотнимающие средства при дегидратации и прочее.
Однако еще более ценны их соли - продукты замещения водорода на металл в составе их молекул. Угольная кислота в этом отношении является особенной. Ведь сама по себе она практически на воздухе сразу распадаясь на и воду. Зато угольная кислота образует соли, которые известны человеку с древних времен. Они пользуются большой популярностью во многих областях производства и деятельности. Их и рассмотрим.
Соли угольной кислоты: классификация
Во-первых, сразу следует указать, что называться рассматриваемые вещества могут по-разному. Так уж повелось, что все названия прижились и используются по сей день, как исторически сложившиеся или тривиальные, так и данные по рациональной номенклатуре. Итак, соли угольной кислоты, называются они так:
- карбонаты;
- бикарбонаты;
- углекислые;
- двууглекислые;
- гидрокарбонаты.
Ну и конечно, у каждой есть еще свое простонародное название, которое является индивидуальным.
В приведенных названиях сразу отражена и классификация рассматриваемых соединений. Так как кислота двухосновная, то и соли она формирует двух видов:
- средние;
- кислые.
К названию последних добавляются приставки гидро- или би-. Практически каждая соль щелочного или щелочноземельного металла - это практически важное соединение, которое нужно людям в хозяйственной деятельности.

История открытия и использования
С самых древних времен людям известны соли угольной кислоты. Ведь еще в Древнем Египте осуществляли строительство при помощи гипса, алебастра, использовали известняк и мрамор.
В трудах Плиния Старшего упоминается технологический процесс получения извести обжигом известняка. Знаменитое чудо света - пирамиды - воздвигались с использованием гипса и материалов, из него полученных. Из золы растений получали поташ и использовали его для стирки белья, а затем и в мыловарении.
То есть использовать продукты, которые дает природа, люди умели практически всегда. Однако то, что это соли угольной кислоты, какое они имеют строение, как можно синтезировать их искусственно, и каковы прочие их характеристики, стало известно много позже, уже в XVII-XVIII веках.

Сегодня также широкое применение находят многие карбонаты щелочных и щелочноземельных металлов, некоторые из них принимают важное участие в процессах циркуляции подземных вод.
Месторождения в природе
По процентному соотношению рассматриваемые минералы занимают примерно 5% от всей массы земной коры. Они образуются в основном снаружи, формируя горные породы. Также много солей формируется гидротермальным путем.
Микроорганизмы, моллюски и прочие животные и растения способствуют образованию карбонатов биохимическим путем. Часто соли угольной кислоты встречаются в составе руд, сопровождая их путем формирования ассоциатов.
Самые известные минералы и горные породы этих соединений:
- кальцит;
- доломит;
- мрамор;
- известняк;
- гипс;
- магнезит;
- сидерит;
- малахит.

Способы получения и применение
Соли угольной кислоты называются карбонаты (если речь идет о средних вариациях). Это значит, что в их состав обязательно входит карбонат-ион, формула которого CO 3 2- . Для завершения полного вида именно соли не хватает лишь катиона металла и индексов, отражающих количественный состав соединения. Это используется в лабораторных способах получения этих веществ.
Ведь помимо добычи из природных источников, углекислые соли можно синтезировать и по реакциям обмена, соединения и замещения. Однако практической значимости такие способы не имеют, так как выход продукта слишком мал и энергозатратен.
Где же осуществляется применение солей угольной кислоты, в каких областях? Для каждой из них это индивидуально, но в общем можно обозначить несколько основных отраслей.
- Строительное дело.
- Химическая промышленность.
- Производство стекла.
- Мыловарение.
- Синтез бумаги.
- Пищевая промышленность.
- Изготовление моющих и чистящих средств.
- Карбонаты кальция - источник ионов металла в организме живых существ.
Рассмотрим конкретно несколько примеров карбонатов, их состав и значение.

Карбонат кальция
Как уже было указано выше, данное вещество - источник ионов кальция Са 2+ в организме человека. А это очень важно. Ведь они принимают участие в поддержании постоянства крови, входят в состав костей, ногтей, волос, укрепляют зубную эмаль.
При недостатке кальция развиваются различные заболевания, в том числе и такие опасные, как сердечная недостаточность, остеопороз, патологические изменения в хрусталике глазного яблока и прочие.
Помимо этого, карбонат кальция также применяется в строительном деле. Ведь его разновидности - это:
- мрамор;
- известняк.
Месторождения данной соли достаточно богаты, чтобы человек не испытывал дефицита в ней. Часто она продается в очищенном виде в форме таблеток, как на фото ниже. Правда, чтобы кальций усваивался достаточно хорошо, требуется присутствие витамина Д.

Углекислый натрий
Соли угольной кислоты - карбонаты - имеют важное значение и в бытовом хозяйстве человека. Так, или углекислый натрий, в простонародье имеет название сода. Однако это не то вещество, которое является важной частью при приготовлении разных блюд. Нет, данная соль используется в хозяйственных целях для чистки бытовых поверхностей изделий: ванн, раковин, посуды и прочих. Она более известна как кальцинированная или бельевая сода, ее же используют в стекольном производстве, мыловарении.
Формула данного соединения Na 2 CO 3 *10H 2 O. Это средняя водная соль, относящаяся к кристаллогидратам. В природе встречается в виде минералов и в составе горных пород. Примеры:
- трона;
- накхолит;
- термонатрит.
Часто выделяется из морских водорослей, их золы. Именно этот способ использовали в древности, чтобы получить сырье для производства мыла или просто постирать белье. Самым же богатым растением, содержащим данную соль, является солянка содоносная. Ее зола максимально приемлема для получения карбоната натрия.
Поташ
Формула соли угольной кислоты, имеющей такое название, - K 2 CO 3 . Это белый мелкокристаллический гигроскопичный порошок. Средняя безводная соль, которая имеет очень хорошую растворимость. Данное соединение также известно людям уже давно, и находит оно широкое применение сегодня. Синонимы названия:
- карбонат калия;
- поташ;
- углекислый калий.
Основные области использования следующие.
- В качестве реагента при процессах производства жидкого мыла.
- Для синтеза хрусталя и оптического стекла, тугоплавкого стекла.
- Для крашения тканей.
- Как удобрение для сельскохозяйственных культур.
- В строительном деле - для снижения температуры замерзания строительных смесей.
- В фотоделе.
Основной промышленный способ получения данной соли - электролиз хлорида кальция. При этом формируется гидроксид, который взаимодействует с и образует поташ. Природное сырье - это зола злаков и водорослей, в которых его содержится много.

Питьевая сода
Кислые соли угольной кислоты имеют не менее важное значение, чем средние. Так, например, бикарбонат натрия, формула которого NaHCO 3 . Другое его название, более известное для всех - Внешне это белый мелкодисперсный порошок, который очень хорошо растворим в воде. Соединение при нагревании неустойчивое, сразу разлагается на углекислый газ, воду и среднюю соль. Это позволяет использовать питьевую соду в качестве буфера во внутренней среде живых организмов.
Также существует еще несколько областей применения данного соединения:
- пищевая (особенно кондитерская) промышленность;
- медицина (для обработки ожогов кислотами);
- в химических синтезах при получении пластмасс, красителей, пенопластов, товаров бытовой химии;
- в легкой и текстильной промышленности (дубление кожи, отделка шелковых тканей и прочее);
- используется при изготовлении газированных напитков и разных кулинарных блюд;
- бикарбонатом натрия заправляют огнетушители.
Гидрокарбонат кальция
Эта кислая соль угольной кислоты - важная часть в циркуляции подземных вод. Данное соединение обеспечивает формирование временной жесткости воды, устраняемой кипячением. При этом именно бикарбонат кальция способствует массовым перемещениям карбонатов в природе, то есть осуществляет их круговорот. Формула этого соединения - Ca(HCO 3) 2 .
Общие сведения Угольная кислота́ слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.



Разложение При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:

Получение Угольная кислота образуется при растворении в воде диоксида углерода. Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа. Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода

Применение Угольная кислота всегда присутствует в водных растворах углекислого газа (газированная вода). В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора

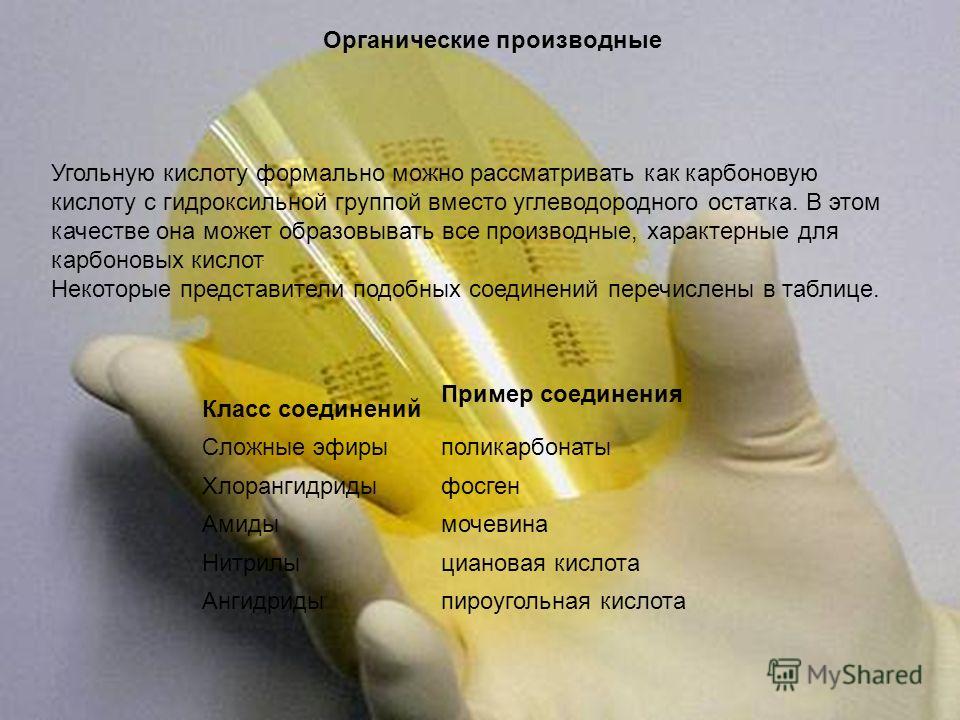
Органические производные Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот. Некоторые представители подобных соединений перечислены в таблице. Класс соединений Пример соединения Сложные эфиры поликарбонаты Хлорангидридыфосген Амидымочевина Нитрилыциановая кислота Ангидридыпироугольная кислота
Оксид углерода (IV), угольная кислота и ее соли
Диоксид углерода СО 2 (углекислый газ) - при обычных условиях это газ без цвета и запаха, слегка кисловатого вкуса, тяжелее воздуха примерно в 1,5 раза, растворим в воде, достаточно легко сжижается (при комнатной температуре под давлением около 60 ∙ 10 5 Па его можно превратить в жидкость). При охлаждении до −56,2ºС жидкий диоксид углерода затвердевает и превращается в снегообразную массу.
Во всех агрегатных состояниях состоит из неполярных линейных молекул. Химическое строение молекулы СО 2 определяется sp-гибридизацией центрального атома углерода и образованием дополнительных π р-р -связей: О = С = О.
Некоторая часть растворенного в воле СО 2 взаимодействует с ней сообразованием угольной кислоты:
СО 2 + Н 2 О ↔ СО 2 ∙ Н 2 О ↔ Н 2 СО 3 .
Углекислый газ очень легко поглощается растворами щелочей с образованием карбонатов и гидрокарбонатов:
СО 2 + 2NaOH = Na 2 CO 3 + H 2 O; СО 2 + NaOH = NaHCO 3 .
Молекулы СО 2 очень устойчивы термически, распад начинается только при температуре 2000ºС. По этой причине диоксид углерода не горит и не поддерживает горения обычного топлива. Но в его атмосфере горят некоторые простые вещества, атомы которых проявляют большое сродство к кислороду, к примеру, магний при нагревании загорается в атмосфере СО 2 .
Угольная кислота H 2 CO 3 – соединение непрочное, существует только в водных растворах. Большая часть растворенного в воде углекислого газа находится в виде гидратированных молекул CO 2 , меньшая – образует угольную кислоту.
Водные растворы, находящиеся в равновесии с CO 2 атмосферы, являются кислыми: = 0,04 М и рН ≈ 4.
Угольная кислота – двухосновная, относится к слабым электролитам, диссоциирует ступенчато (К 1 = 4, 4 ∙ 10 −7 ; К 2 = 4, 8 ∙ 10 −11). При растворении CO 2 в воде устанавливается следующее динамическое равновесие:
H 2 O + CO 2 ↔ CO 2 ∙ H 2 O ↔ H 2 CO 3 ↔ H + + HCO 3 −
При нагревании водного раствора углекислого газа растворимость газа понижается, CO 2 выделяется из раствора, и равновесие смещается влево.
Будучи двухосновной, угольная кислота образует два ряда солей: средние соли (карбонаты) и кислые (гидрокарбонаты). Большинство солей угольной кислоты бесцветны. Из карбонатов растворимы в воде лишь соли щелочных металлов и аммония.
В воде карбонаты подвергаются гидролизу, и в связи с этим их растворы имеют щелочную реакцию:
Na 2 CO 3 + H 2 O ↔ NaHCO 3 + NaOH.
Дальнейший гидролиз с образованием угольной кислоты в обычных условиях практически не идет.
Растворение в воде гидрокарбонатов также сопровождается гидролизом, но в значительно меньшей степени, и среда создается слабощелочная (рН ≈ 8).
Карбонат аммония (NH 4) 2 CO 3 отличается большой летучестью при повышенной и даже при обычной температуре, особенно в присутствии паров воды, которые вызывают сильный гидролиз.
Сильные кислоты и даже слабая уксусная кислота вытесняют из карбонатов угольную кислоту:
K 2 CO 3 + H 2 SO 4 = K 2 SO 4 + H 2 O + CO 2 .
В отличие от большинства карбонатов, все гидрокарбонаты в воде растворимы. Οʜᴎ менее устойчивы, чем карбонаты тех же металлов и при нагревании легко разлагаются, превращаясь в соответствующие карбонаты:
2KHCO 3 = K 2 CO 3 + H 2 O + CO 2 ;
Ca(HCO 3) 2 = CaCO 3 + H 2 O + CO 2 .
Сильными кислотами гидрокарбонаты разлагаются, как и карбонаты:
KHCO 3 + H 2 SO 4 = KHSO 4 + H 2 O + CO 2
Из солей угольной кислоты наибольшее значение имеют карбонат натрия (сода), карбонат калия (поташ), карбонат кальция (мел, мрамор, известняк), гидрокарбонат натрия (питьевая сода) и основной карбонат меди (CuOH) 2 CO 3 (малахит).
Основные соли угольной кислоты в воде практически нерастворимы и при нагревании легко разлагаются:
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O.
Термическая устойчивость карбонатов зависит от поляризационных свойств ионов, входящих в состав карбоната. Чем больше поляризующее действие оказывает катион на карбонат-ион, тем ниже температура разложения соли. В случае если катион способен легко деформироваться, то карбонат-ион сам также будет оказывать поляризующее действие на катион, что приведет к резкому снижению температуры разложения соли.
Карбонаты натрия и калия плавятся без разложения, а большинство остальных карбонатов при нагревании разлагаются на оксид металла и углекислый газ:
MgCO 3 = MgO + CO 2 .
Оксид углерода (II)
Молекула СО имеет следующую структуру
: С≡ О:
Две связи образованы за счёт спаривания 2р-электронов атомов углерода и кислорода, третья связь образована по донорно-акцепторному механизму за счёт свободной 2р-орбитали углерода и 2р-электронной пары атома кислорода. Дипольный момент молекулы незначителен, при этом эффективный заряд на атоме углерода отрицательный, а на атоме кислорода – положительный.
Поскольку строение молекулы СО сходно со строением молекулы азота͵ похожи их физические свойства. СО имеет очень низкие температуры плавления (- 204ºС) и кипения (- 191,5ºС), это бесцветный, очень ядовитый газ, без запаха, совсем немного легче воздуха. Плохо растворим в воде, и с ней не взаимодействует.
СО считается несолеобразующим оксидом, т.к. при обычных условиях не взаимодействует ни с кислотами, ни со щелочами. Он образуется при горении угля и углеродистых соединений при ограниченном доступе кислорода, также при взаимодействии углекислого газа с раскаленным углем: СО 2 + С = 2СО.
В лаборатории его получают из мурвьиной кислоты действием на нее концентрированной серной кислоты при нагревании:
НСООН + H 2 SO 4 (конц.) = CO + H 2 SO 4 ∙ H 2 O.
Можно использовать также и щавелевую кислоту. Серная кислота в этих реакциях выступает как водоотнимающее средство.
В обычных условиях СО химически достаточно инертен, но при нагревании проявляет восстановительные свойства, что широко используется в пирометаллургии для получения некоторых металлов: Fe 2 O 3 + 3CO = 2Fe + 3CO 2 .
На воздухе СО горит голубоватым пламенем с выделением большого количества теплоты: 2СО + О 2 = 2СО 2 + 569 кДж.
Помимо кислорода на прямом солнечном свету или в присутствии катализатора (активного угля) СО соединяется с хлором, образуя фосген:
СО + Cl 2 = COCl 2 .
Фосген – бесцветный газ с характерным запахом. В воде он малорастворим, но как хлорангидрид угольной кислоты постепенно гидролизуется по схеме: COCl 2 + 2H 2 O = 2HCl + H 2 CO 3 . Вследствие высокой токсичности фосген применяли как боевое отравляющее средство в первую мировую войну. Обезвредить его можно с помощью гашеной извести.
При нагревании СО окисляется и серой: СО + S = COS.
Молекула СО может выступать в качестве лиганда в различных комплексных соединениях. За счёт несвязывающей электронной пары углерода она проявляет σ-донорные свойства, а за счёт свободных π-разрыхляющих орбиталей проявляет π-акцепторные свойства. Особый интерес представляют карбонильные комплексы d-металлов, т.к. термическим разложением карбонилов получают металлы высокой чистоты.