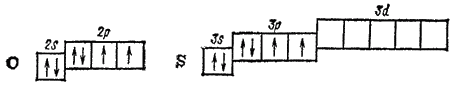
Периоди ческая система химических элементов — это графическое выражение периодического закона. Группой
16. Какой из газов, взятых одинаковой массой занимает наибольший объем при одинаковых условиях:
17. Определите молярную массу эквивалента (г/моль) серы в оксиде серы (VI):
18. Какова массовая доля (%) металла в оксиде если молярная масса эквивалента трехвалентного металла равна 15 г/моль:
19. Какова относительная молекулярная масса газа, если этот газ тяжелее воздуха в 2,2 раза:
20. Какое из приведенных уравнений называется уравнением Менделеева – Клапейрона:
3) PV = RT
21. Укажите 3 газа, имеющих одинаковую плотность по любому другому газу:
1) CH 4 , SO 2 , Cl 2
2) C 2 H 4 , CH 4 , F 2
3) CO, Cl 2 , H 2
4) CO, C 2 H 4 , N 2
5)N 2 , CH 4 , H 2
22. Сколько молей кислорода образуется из 3 моль хлората калия при его полном термическом разложении:
23. Какое количество (моль) FeS 2 потребуется для получения 64 г SO 2 по уравнению:
4 FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2 ;
24. Какая масса (г) карбоната кальция будет израсходована для получения 44,8 л углекислого газа, измеренного при н.у.:
1) 200,0;
25.Эквивалентом алюминия является:
1) атом алюминия;
2) 1/2 часть атом алюминия;
3) 1/3 часть атом алюминия;
4) два атома алюминия;
5) 1 моль атомов алюминия.
26.Закон постоянства состава веществ справедлив для веществ:
1) с молекулярным строением;
2) с немолекулярным строением;
3) с ионной кристаллической решеткой;
4) с атомной кристаллической решеткой;
5) для оксидов и солей.
27. Эквивалентом магния является:
1) атом магния;
2) 1/2 часть атома магния;
3) 1/3 часть атома магния;
4) два атома магния;
5) 1 моль атомов магния.
28. На нейтрализацию 2,45 г кислоты расходуется 2,80 г гидроксида калия. Определить
молярную массу эквивалента кислоты:
1) 98 г/моль;
2) 36,5 г/моль;
3) 63 г/моль;
4) 40 г/моль;
Г/моль.
Классификация и номенклатура неорганических соединений
1) Na 2 O; CaO; CO 2
2)SO 3 ; CuO; CrO 3
3)Mn 2 O 7 ; CuO; CrO 3
4)SO 3 ; CO 2 ; P 2 O 5
5) Na 2 O; H 2 O; CO 2
30. Лишь кислотные оксиды ряд:
1) CO 2 ; SiO 2 ; MnO; CrO 3
2) V 2 O 5 ; CrO 3 ; TeO 3 ; Mn 2 O 7
3) CuO; SO 2 ; NiO; MnO
4) CaO; P 2 O 3 ; Mn 2 O 7 ; Cr 2 O 3
5) Na 2 O; H 2 O; CuO; Mn 2 O 7
31. Не может быть использовано для нейтрализации серной кислоты:
1) гидрокарбонат натрия;
2) оксид магния;
3) хлорид гидроксомагния;
4) гидросульфат натрия;
5) оксид натрия
32. Для нейтрализации серной кислоты можно использовать:
2) Mg(OH) 2
33. С помощью стеклянной трубки выдыхают углекислый газ в растворы. Изменение будет в растворе:
3) Ca(OH) 2 ;
34. Растворением в воде соответствующего оксида можно получить:
35. При определенных условиях образуется соль в случае:
1) N 2 O 5 +SO 3 ;
4) H 2 SO 4 +NH 3 ;
36. Может образовывать кислые соли:
1) H 3 PO 4 ;
37. Может образовывать основные соли:
2) Ba(OH) 2 ;
38. Масса известняка, необходимая для получения 112 кг негашеной извести:
39. Реагирует с водой:
2) CаO;
40. Растворим в воде:
3) Ba(OH) 2 ;
41. Для получения фосфата калия на гидрофосфат калия надо подействовать:
42. Кислотный оксид:
3) Mn 2 O 7 ;
43. Будут непосредственно взаимодействовать в водном растворе:
2) Cu(OH) 2 и ZnO;
3) AI 2 O 3 и HCI;
4) Rb 2 O и NaOH;
5) CaO и K 2 O.
44. Все соли кислые в группе:
1) KCI, CuOHCI, NaHSO 4 ;
2) KAI(SO 4) 2 , Na, Ca(HCO 3) 2 ;
3) CuS, NaHSO 3 , Cu(HS) 2 ;
4) NaHCO 3 , Na 2 HPO 4 , NaH 2 PO 4 ;
5) AIOHCI 2 , NaHCO 3 , NaCN.
45. Не образует кислых солей:
4) HPO 3 ;
46. Составлено неверно название:
1) сульфат железа;
2) сульфат калия;
3) гидрохлорид железа (II);
4) хлорид меди (I);
5) сульфат аммония.
47. При отщеплении воды от одноосновной кислоты массой 16,0 г, образованной элементом в степени окисления +5, получится оксид массой 14,56 г. Была взята кислота:
1) азотная;
2) метаванадиевая;
3) ортофосфорная;
4) мышьяковая;
5) хлорноватая.
48. При прокаливании на воздухе металла (III) массой 10, 8 г получен оксид металла массой 20, 4 г. Для прокаливания был взят:
2) алюминий AI;
3) железо Fe;
4) скандий Sc;
5) натрий Na.
49. Признак, характеризующий соляную кислоту:
1) двухосновная;
2) слабая;
3) летучая;
4) кислородсодержащая;
5) кислота – окислитель.
50. Двухосновная кислота:
1) азотная;
2) соляная;
3) уксусная;
4) синильная;
Селеновая.
51. Одноосновная кислота:
1) селенистая;
2) фосфористая;
3) теллуровя;
4) борная;
5) синильная.
52. Два типа кислых солей образует:
1) серная кислота;
2) ортофосфорная кислота;
3) метафосфорная кислота;
4) селеновая кислота;
5) сернистая кислота.
53. Не образует кислых солей:
1) серная кислота;
2) ортофосфорная кислота;
3) метафосфорная кислота;
4) селеновая кислота;
5) сернистая кислота.
54. Укажите катионный комплекс:
1) Na 3 ;
3) K 3 ;
4) CI 3 ;
5) K 2 .
55. Комплексный неэлектролит:
1) Na 3 ;
2) ;
3) K 3 ;
4) CI 3 ;
5) K 2 .
56. Анионный комплекс:
1) гексацианоферрат (III) калия;
2) тетрахлородиамминплатина (IV);
3) хлорид диамминсеребра;
57. Комплексный неэлектролит:
1) гексацианоферрат (III) калия;
2) тетрахлородиамминплатина (IV);
3) хлорид диамминсеребра;
4) сульфат тетраамминмеди (II);
5) хлорид гексааквахрома (III).
58. Формула хлорида гексааквахрома (III):
1) Na 3 ;
2) CI
3) CI 2 ;
4) CI 3 ;
5)K 2 Cr 2 O 7 .
59. Формула хлорида гексааквахрома (II):
1) Na 3 ;
2) CI
3) CI 2 ; 3bl
4) CI 3 ;
5)K 2 Cr 2 O 7 .
60. Желтая кровяная соль относится:
1) К аквакомплексам;
2) Гидратам;
3) К ацидокомплексам;
4) К аммиакатам;
5) К хелатам.
61. Медный купорос относится:
1) К аквакомплексам;
2) Гидратам;
3) К ацидокомплексам;
4) К аммиакатам;
5) К хелатам.
62. Для получения СаСО 3 к раствору Са(НСО 3) 2 следует прибавить:
1) Са(ОН) 2 ;
“Строение вещества и периодический закон Д.И. Менделеева”
63. В ядре наиболее распространенного изотопа свинца 207 Pb нейтронов:
2) 125
64. Максимальное число электронов на уровне n = 3:
65. На энергетическом уровне с n = 4 подуровней:
66. Число энергетических уровней в атоме вольфрама:
67. В ядре атома осмия протонов:
68. Ядро атома криптона содержит:
Р и 44n
69. Число электронов у иона хрома :
70. Ион, имеющий в своем составе 18 электронов и 16 протонов, обладает зарядом ядра:
71. Максимальное число электронов, которые могут занимать 3s-орбиталь:
72. Электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 имеет атом:
73. Неверны обозначения орбиталей:
3) 1p, 2d
74. Одинаковую с атомом аргона электронную конфигурацию имеет частица:
1) Са 2+
75. Сродством к электрону называют:
1) энергию, необходимую для отрыва электрона от невозбужденного атома;
2) способность атома данного элемента к оттягиванию на себя электронной плотности;
3) переход электрона на более высокий энергетический уровень;
4) выделение энергии при присоединении электрона к атому или иону;
5) энергию химической связи.
76. В результате ядерной реакции ![]() образуется изотоп:
образуется изотоп:
77. В атоме водорода поглощения фотона с минимальной энергией требует переход электрона:
78. Корпускулярно-волновую природу электрона характеризует уравнение:
79. Для валентного электрона атома калия возможны значения квантовых чисел (n, l , m l , m s):
1) 4, 1, -1, - :
2) 4, 1, +1, + : 3bm
3) 4, 0, 0, + :
4) 5, 0, +1, + :
80. Заряд ядра атома, у которого конфигурация валентных электронов в основном состоянии …4d 2 5s 2:
81. Главное квантовое число n определяет:
1) форму электронного облака;
2) энергию электрона;
82. Орбитальное квантовое число l определяет:
1) форму электронного облака;
2) энергию электрона;
3) ориентацию электронного облака в пространстве;
4) вращение электрона вокруг собственной оси;
5) гибридизацию электронного облака.
83. Магнитное квантовое число m определяет:
1) форму электронного облака;
2) энергию электрона;
3) ориентацию электронного облака в пространстве;
4) вращение электрона вокруг собственной оси;
5) гибридизацию электронного облака.
84. Спиновое квантовое число m s определяет:
1) форму электронного облака;
2) энергию электрона;
3) ориентацию электронного облака в пространстве;
4) вращение электрона вокруг собственной оси;
5) гибридизацию электронного облака.
85. При - распаде ядро атома радиоактивного элемента испускает:
1) электрон;
2) позитрон;
4) два протона;
5) два нейтрона.
86. При - - распаде ядро атома радиоактивного элемента испускает:
1) электрон;
2) позитрон;
3) два протона и два нейтрона, объединенные в ядро атома гелия;
4) два протона;
5) два нейтрона.
87. При + - распаде ядро атома радиоактивного элемента испускает:
1) электрон;
2) позитрон;
3) два протона и два нейтрона, объединенные в ядро атома гелия;
4) два протона;
5) два нейтрона.
88. Наименьшее значение суммы (n + l) имеет атомная орбиталь:
89. Наибольшее значение суммы (n + l) имеет атомная орбиталь
90. Атом азота будет более устойчивым, если на 2р-подуровне три электрона распределяются по одному на каждой орбитали. Это соответствует содержанию:
2) Принципа Паули;
3) Правила Гунда;
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
91. Двадцать первый электрон атома скандия располагается на 3d–подуровне, а не на 4р–подуровне. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули;
3) Правила Гунда;
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
92. Девятнадцатый электрон атома калия располагается на 4s–подуровне, а не на 3d- подуровне. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули;
3) Правила Гунда;
4) 1-го правила Клечковского ;
5) 2-го правила Клечковского.
93. Единственный электрон атома водорода в основном состоянии располагается на первом энергетическом уровне. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули;
3) Правила Гунда;
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
94. Максимальное число электронов на втором энергетическом уровне атомов элементов
равно 8. Это соответствует содержанию:
1) Принципа наименьшей энергии;
2) Принципа Паули;
3) Правила Гунда;
4) 1-го правила Клечковского;
5) 2-го правила Клечковского.
95. Один из механизмов образования ковалентной связи:
1) радикальный;
2) обменный;
3) молекулярный;
4) ионный;
5) цепной.
96. Примером неполярной молекулы, имеющей полярную ковалентную связь, будет:
4) CCl 4
97. Неполярная молекула:
98. В ряду молекул LiF – BeF 2 - BF 3 - CF 4 - NF 3 - OF 2 - F 2:
1) характер связи не меняется;
2) ионный характер связи усиливается;
3) ковалентный характер связи ослабевает;
4) ковалентный характер связи усиливается;
5) правильного варианта ответа нет.
99. Ковалентная связь по донорно-акцепторному механизму образуется в молекуле:
2) CCl 4 ;
3) NH 4 C1;
4) NH 3 ;
100. В молекуле азота образуются:
1) только -связи;
2) только -связи;
3) как -, так и -связи;
4) одинарная связь;
5) двойная связь.
101. Молекула метана имеет структуру:
1) плоскую;
2) тетраэдрическую ;
3) пирамидальную;
4) квадратную;
102. Образование ионной решетки характерно для:
1) иодида цезия;
2) графита;
3) нафталина;
4) алмаза;
103. Для какого из перечисленных ниже веществ характерно образование атомной решетки:
1) нитрат аммония;
2) алмаз;
4) хлорид натрия;
5) натрий.
104. Химические элементы расположены в порядке возрастания электроотрицательности в
1) Si, P, Se, Br, Cl, O;
2) Si, P, Br, Se, Cl, O;
3) P, Si, Br, Se, Cl, O;
4) Br, P, Cl, Si, Se;
5) Si, P, Se, Cl, O, Br
105. Валентные орбитали атома бериллия в молекуле гидрида бериллия … гибридизованы
106. Молекула гидрида бериллия имеет структуру:
1) квадратную
Плоскую
3) тетраэдрическую
5) шарообразную.
107. Валентные орбитали атома бора в молекуле BF 3 гибридизованы по типу:
108. Какая из молекул является наиболее прочной?
109. Какая из указанных молекул имеет наибольший диполь?
110. Какую пространственную конфигурацию имеет молекула при sp 2 гибридизации АО:
1) линейная
2) тетраэдр
3) плоский квадрат
Плоская тригональная
111.Молекула имеет октаэдрическое строение если происходит следующая гибридизация
3) d 2 sp 3
112. Современная теория строения атома основана на представлениях:
1) классической механики;
2) квантовой механики;
3) теории Бора;
4) электродинамики;
5) химической кинетики.
113. Из перечисленных ниже характеристик атомов элементов периодически изменяются:
1) заряд ядра атома
2) относительная атомная масса;
3) число энергетических уровней в атоме;
4) число электронов на внешнем энергетическом уровне;
5) общее число электронов.
114. Внутри периода увеличение порядкового номера элемента обычно сопровождается:
1) уменьшением атомного радиуса и возрастанием электроотрицательности атома;
2) возрастанием атомного радиуса и уменьшением электроотрицательности атома;
3) уменьшением атомного радиуса и уменьшением электороотрицательности атома
4) возрастанием атомного радиуса и возрастанием электроотрицательности атома
5) уменьшением электроотрицательности.
115. Атом какого из элементов легче всего отдает один электрон:
1) натрий, порядковый номер 11;
2) магний, порядковый номер 12;
3) алюминий, порядковый номер 13;
4) кремний, порядковый номер 14;
5) сера, порядковый номер 16.
116. Атомы элементов IА группы периодической системы элементов имеют одинаковое число:
1) электронов на внешнем электронном уровне;
2) нейтронов;
3) всех электронов;
5) протонов.
117. Какой из приведенных элементов назван в честь страны:
118. Какой ряд включает только переходные элементы:
1) элементы 11, 14, 22, 42;
2) элементы 13, 33, 54, 83;
3) элементы 24, 39, 74, 80;
4) элементы 19, 32, 51, 101;
5) элементы 19, 20, 21, 22.
119. Атом какого из элементов VА группы имеет максимальный радиус:
2) фосфор;
3) мышьяк;
4) висмут;
5) сурьма.
120. Какой ряд элементов представлен в порядке возрастания атомного радиуса:
1) О, S, Se, Te;
3) Na, Mg, AI, Si;
4) J, Br, CI, F;
5) Sc, Te, V, Cr .
121. Металлический характер свойств элементов в ряду Mg – Ca – Sr – Ba
1) уменьшается;
2) возрастает;
3) не изменяется;
4) уменьшается, а затем возрастает;
5) увеличивается, а затем уменьшается.
122. Основные свойства гидроксидов элементов JА группы по мере увеличения порядкового номера
1) уменьшаются,
2) возрастают,
3) остаются неизменными,
4) уменьшаются, а затем возрастают,
5) возрастают, а затем уменьшаются.
123. Простые вещества каких элементов обладают наибольшим сходством физических и химических свойств:
3) F, CI;
124. Существование каких из приведенных элементов было предсказано Д.И. Менделеевым:
3) Sc, Ga, Ge;
125. Что отличает большие периоды от малых:
1) наличие щелочных металлов;
2) отсутствие инертных газов;
3) наличие d- и f- элементов;
4) наличие неметаллов;
5) наличие элементов с металлическими свойствами.
126.Как по электронной формуле элемента определить период, в котором находится данный элемент:
1) по значению главного квантового числа внешнего энергетического уровня ;
2) по числу валентных электронов;
3) по числу электронов во внешнем энергетическом уровне;
4) по количеству подуровней во внешнем энергетическом уровне;
5)по значению подуровня, где находится последний валентный электрон.
127. Какой элемент имеет наименьший ионизационный потенциал:
128. Химический элемент третьего периода образует высший оксид состава Э 2 О 3 . Как распределяются электроны в атоме данного элемента?
1) 1s 2 2s 2 2p 1
2) 1s 2 2s 2 2p 6 3s 1
3) 1s 2 2s 2 2p 6 3s 2 3p 1
4) 1s 2 2s 2 2p 6 3s 2 3p 6
5) 1s 2 2s 2 2p 3
129.Какой химический элемент образует основание с наиболее ярко выраженными свойствами
1) кальций
3) алюминий
Калий
5) берилий
130. Химический элемент имеет следующее распределение электронов по электронным слоям в атоме 2.8.6. Какое положение он занимает в периодической системе химических элементов Д.И. Менделеева:
1) 6 период 6 группа
Период 6 группа
3) 2 период 6 группа
4) 3 период 2 группа
5) 2 период 8 группа
131. Квантовые числа последнего электрона в атоме элемента, равны n = 5, l = 1, m = -1, m s = - . Где находится этот элемент в периодической системе?
1) 5 период, первая группа
2) 5 период, главная подгруппа 4 группы
3) 4 период, шестая группа
период, шестая группа главная подгруппа
5) 5 период, шестая группа побочная подгруппа.
132. Формула высшего оксида химического элемента ЭО 2 . К какой группе главной подгруппы периодической системы химических элементов Д.И. Менделеева принадлежит этот элемент?
Четвертая
5) шестая.
133. Из приведенного перечня элементов - Li, Na, Ag, Au, Ca, Ba- к щелочным металлам относятся:
1) все металлы;
2) Li, Na;
3) Li, Na, Ag, Au;
134. В ряду от Li к Fr:
1) усиливаются металлические свойства;
2) уменьшаются металлические свойства;
3) уменьшается атомный радиус;
4) усиливается связь валентных электронов с ядром;
5) уменьшается активность по отношению к воде
135. К металлам не относится последовательность элементов:
3) B, As, Te;
136. С ростом порядкового номера элемента кислотные свойства оксидов N 2 O 3 - P 2 O 3 - As 2 O 3
Sb 2 O 3 - Bi 2 O 3
1) усиливаются;
2) ослабевают;
3) остаются неизменными;
4) усиливаются, затем ослабевают;
5) ослабевают, затем усиливаются.
137. Молекула аммиака имеет форму:
1) изогнутую;
2) линейную;
3) плоскостную;
4) пирамидальную;
138. В ряду С-Si-Ge-Sn-Pb неметаллические признаки элементов:
1) возрастают;
2) ослабевают;
3) не изменяються;
4) возрастают а затем ослабевают;
5) ослабевают а затем возрастают.
139. Валентные орбитали у атома углерода в молекуле метана СН 4 можно описать на основе
представлений о гибридизации типа (sp; sp 2 ; sp 3 ; d 2 sp 3 ; dsp 2).
При этом молекула метана имеет форму:
1) линейную;
2) плоскую;
3) тетраэдрическую;
5) квадратную.
140. Валентные орбитали у атома кремния в молекуле силана SiH 4 можно описать на основе представления о гибридизации типа (sp; sp 2 ; sp 3 ; d 2 sp 3 ; dsp 2).
Поэтому молекула силана имеет форму:
1) линейную;
2) плоскую;
3) тетраэдричесую;
5) квадратную.
141.Какое максимальное число ковалентных связей может образовывать атом азота:
142. Атом азота молекулы аммиака с ионом водорода образует:
1) ионную связь;
2) ковалентную связь по обменному механизму;
3) неполярную ковалентную связь;
4) ковалентную связь по донорно - акцепторному механизму;
5) водородную связь.
143. Какое утверждение неверно:
4) Ионная связь обладает насыщаемостью ;
144. Какое утверждение неверно:
1) Ковалентная связь обладает насыщаемостью;
2) Ковалентная связь обладает направленностью;
3) Ионная связь обладает ненасыщаемостью;
4) Ионная связь обладает направленностью;
5) Ионная связь обладает ненаправленностью.
“Закономерности химических процессов и их энергетика”
145. Какие изменения температуры Т и давления Р способствует образованию СО по реакции С(тв.) + СО 2 (г.) 2СО (г.) -119,8 кДж:
1) повышение Т и повышение Р;
2) повышение Т и понижение Р;
3) понижение Т и повышение Р;
4) понижение Т и понижение Р;
5) повышение Р.
146.Во сколько раз увеличится скорость химической реакции при увеличении температуры на 30 0 , если температурный коэффициент скорости равен 2 ?
147. На сколько градусов надо понизить температуру, чтобы скорость реакции уменьшилась в 27 раз, если температурный коэффициент скорости равен 3 ?
148. Во сколько раз возрастет скорость реакции Х+ 2Y = Z при увеличении концентрации
Y в 3 раза?
149. Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в системе 2NO + O 2 2NO 2 при увеличении давления в 2 раза?
150. Укажите правильное выражение скорости для системы: 2Cr+3Cl 2 = 2CrCl 3
154. Катализатор ускоряет химическую реакцию благодаря:
1) снижению энергии активации;
2) повышению энергии активации;
3) уменьшению теплоты реакции;
4) увеличению концентрации;
5) все ответы не верны.
155. Равновесие реакции Fe 3 O 4 +4CO «3Fe +4CO 2 -43.7 кДж смещается влево:
1) при понижении температуры;
2) при повышении температуры;
3) при повышении давления;
4) при увеличении концентрации исходных веществ;
5) при добавлении катализатора.
156.Во сколько раз увеличится скорость химической реакции при увеличении температуры на 30 0 , если температурный коэффициент скорости равен 3?
157. На сколько градусов надо повысить температуру, чтобы скорость реакции увеличилась в 27 раз, если температурный коэффициент скорости равен 3?
158. Во сколько раз возрастает скорость реакции X+2Y=Z при увеличении концентрации Х в 3 раза?
159. Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в системе 2СO+O 2 2СO 2 при увеличении давления в 2 раза?
160. Как увеличится скорость газовой реакции 2NO 2 =N 2 O 4 при увеличении концентрации NO 2 в 5 раз?
161. Во сколько раз уменьшится скорость газовой реакции 2NO+O 2 =2NO 2 при разбавлении смеси реагирующих газов в 3 раза?
162. На сколько градусов надо понизить температуру, чтобы скорость реакции уменьшилась в 81 раз при температурном коэффициенте, равном 3?
163. Во сколько раз станет больше скорость реакции 2NO+O 2 =2NO 2 при увеличении давления в системе в 4 раза?
164. Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в системе 2NO+O 2 2NO 2 при увеличении давления в системе в 5 раз?
165. Как изменится скорость реакции 2SO 2,г +O 2,г 2SO 3,г при увеличении концентрации 1) увеличится в 3 раза; 2) увеличится в 9 раз;
3) уменьшится в 3 раза; 4) уменьшится в 9 раз; 5) не изменится. 166. Как изменится скорость реакции 2О 3,г 3О 2,г при увеличении давления в 2 раза? 1) уменьшится в 2 раза; 2) уменьшится в 8 раз; 3) увеличится в 4 раза;
4) уменьшится в 4 раза; 5) увеличится в 2 раза. 167. Как изменится скорость реакции 2NО г +О 2,г 2NO 2,г при одновременном уменьшении концентрации NO и O 2 в 2 раза? 1) возрастет в 2 раза; 2) уменьшится в 2 раза; 3) возрастет в 2 4 раза; 4) уменьшится в 2 4 раза; Уменьшится в 8 раз.
168. Как изменится скорость прямой реакции H 2 O ,г Н 2,г + О 2,г если давление в системе увеличится в 4 раза? 1) увеличится в 2 раза; 2) уменьшится в2 раза; 3) не изменится; 4) увеличится в 4 раза;
5) уменьшится в 4 раза. 169. Закон действия масс был открыт: 1) М.В. Ломоносовым 2) Г.И. Гессом 3) Дж.У. Гиббсом К. Гульдбергом и П. Вааге
5) Вант – Гоффом 170. Какая из указанных систем является гомогенной Раствор хлорида натрия
2) вода со льдом 3) насыщенный раствор с осадком 4) уголь и сера в атмосфере воздуха 5) смесь бензина с водой 171. Величина константы скорости химической реакции не зависит 1) от природы реагирующих веществ 2) от температуры 3) от присутствия катализаторов От концентрации веществ
5) ни от каких факторов 172. Энергия активации – это 1) энергия, необходимая для отрыва электрона от атома 2) избыточная энергия которой должны обладать молекулы в расчете на 1 моль для ого, чтобы их столкновение могло привести к образованию нового вещества 3) потенциал ионизации 4) энергия, которая выделяется в результате реакции 5) энергия, которая выделяется при присоединении электрона к атому. 173. Возрастание скорости реакции с ростом температуры принято характеризовать: 1) константой скорости химической реакции 2) константой химического равновесия К главной подгруппе V группы периодической системы принадлежат азот, фосфор, мышьяк, сурьма и висмут. Эти элементы, имея пять электронов в наружном слое атома, характеризуются в целом как неметаллы. Однако способность к присоединению электронов выражена у них значительно слабее, чем у соответствующих элементов VI и VII групп. Благодаря наличию пяти наружных электронов, высшая положительная окисленность элементов этой подгруппы равна -5, а отрицательная - 3. Вследствие относительно меньшей электроотрицательности связь рассматриваемых элементов с водородом менее полярна, чем связь с водородом элементов VI и VII групп. Поэтому водородные соединения этих элементов не отщепляют в водном растворе ионы водорода H, таким образом, не обладают кислотными свойствами. Физические и химические свойства элементов подгруппы азота изменяются с увеличением порядкового номера в той же последовательности, которая наблюдалась в ранее рассмотренных группах, Но так как неметаллические свойства выражены у слабее, чем у кислорода и тем более фтора, то ослабление этих свойств при переходе к следующим элементам влечет за собой появление и нарастание металлических свойств. Последние заметны уже у мышьяка, сурьма приблизительно в равной степени обладает теми и другими свойствами, а у висмута металлические свойства преобладают над неметаллическими. ОПИСАНИЕ ЭЛЕМЕНТОВ. АЗОТ
(от греч. ázōos - безжизненный, лат. Nitrogenium), N, химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14,0067; бесцветный газ, не имеющий запаха и вкуса. Историческая справка. Соединения азота - селитра, азотная кислота, аммиак - были известны задолго до получения азота в свободном состоянии. В 1772 Д. Резерфорд, сжигая фосфор и др. вещества в стеклянном колоколе, показал, что остающийся после сгорания газ, названный им "удушливым воздухом", не поддерживает дыхания и горения. В 1787 А. Лавуазье установил, что "жизненный" и "удушливый" газы, входящие в состав воздуха, это простые вещества, и предложил название "азот". В 1784 Г. Кавендиш показал, что азот входит в состав селитры; отсюда и происходит латинское название азот (от позднелатинское nitrum - селитра и греческое gennao - рождаю, произвожу), предложенное в 1790 Ж. А. Шапталем. К началу 19 в. были выяснены химическая инертность азота в свободном состоянии и исключительная роль его в соединениях с др. элементами в качестве связанного азота. С тех пор "связывание" азота воздуха стало одной из важнейших технических проблем химии. Распространённость в природе. Азот - один из самых распространённых элементов на Земле, причём основная его масса (около 4´1015 т) сосредоточена в свободном состоянии в атмосфере. В воздухе свободный азот (в виде молекул N2) составляет 78,09% по объёму (или 75,6% по массе), не считая незначительных примесей его в виде аммиака и окислов. Среднее содержание азота в литосфере 1,9´10-3% по массе. Природные соединения азота. - хлористый аммоний NH4Cl и различные нитраты (см. Селитры.) Крупные скопления селитры характерны для сухого пустынного климата (Чили, Средняя Азия). Долгое время селитры были главным поставщиком азота для промышленности (сейчас основное значение для связывания азота имеет промышленный синтез аммиака из азота воздуха и водорода). Небольшие количества связанного азота находятся в каменном угле (1-2,5%) и нефти (0,02-1,5%), а также в водах рек, морей и океанов. Азот накапливается в почвах (0,1%) и в живых организмах (0,3%). Хотя название "азот" означает "не поддерживающий жизни", на самом деле это - необходимый для жизнедеятельности элемент. В белке животных и человека содержится 16 - 17% азота. В организмах плотоядных животных белок образуется за счёт потребляемых белковых веществ, имеющихся в организмах травоядных животных и в растениях. Растения синтезируют белок, усваивая содержащиеся в почве азотистые вещества, главным образом неорганические. Значительные количества азота поступают в почву благодаря азотфиксирующим микроорганизмам, способным переводить свободный азот воздуха в соединения азота. В природе осуществляется круговорот азота, главную роль в котором играют микроорганизмы - нитрофицирующие, денитрофицирующие, азотфиксирующие и др. Однако в результате извлечения из почвы растениями огромного количества связанного азота (особенно при интенсивном земледелии) почвы оказываются обеднёнными азотом. Дефицит азота характерен для земледелия почти всех стран, наблюдается дефицит азота и в животноводстве ("белковое голодание"). На почвах, бедных доступным азотом, растения плохо развиваются. Азотные удобрения и белковая подкормка животных - важнейшее средство подъёма сельского хозяйства. Хозяйственная деятельность человека нарушает круговорот азота. Так, сжигание топлива обогащает атмосферу азотом., а заводы, производящие удобрения, связывают азот воздуха. Транспортировка удобрений и продуктов сельского хозяйства перераспределяет азот на поверхности земли. Азот - четвёртый по распространённости элемент Солнечной системы (после водорода, гелия и кислорода). Изотопы, атом, молекула. Природный азот состоит из двух стабильных изотопов: 14N (99,635%) и 15N (0,365%). Изотоп 15N применяют в химических и биохимических исследованиях в качестве меченого атома. Из искусственных радиоактивных изотопов азота наибольший период полураспада имеет 13N (T1/2 - 10,08 мин), остальные весьма короткоживущие. В верхних слоях атмосферы, под действием нейтронов космического излучения, 14N превращается в радиоактивный изотоп углерода 14C. Этот процесс используют и в ядерных реакциях для получения 14C. Внешняя электронная оболочка атома азота. состоит из 5 электронов (одной неподелённой пары и трёх неспаренных - конфигурация 2s22p3). Чаще всего азот. в соединениях З-ковалентен за счёт неспаренных электронов (как в аммиаке NH3). Наличие неподелённой пары электронов может приводить к образованию ещё одной ковалентной связи, и азот становится 4-ковалентным (как в ионе аммония NH4+). Степени окисления азота меняются от +5 (в N205) до -3 (в NH3). В обычных условиях в свободном состоянии азот образует молекулу N2, где атомы N связаны тремя ковалентными связями. Молекула азота очень устойчива: энергия диссоциации её на атомы составляет 942,9 кДж/моль (225,2 ккал/моль), поэтому даже при t около 3300°C степень диссоциации азот. составляет лишь около 0,1%. Физические и химические свойства. Азот немного легче воздуха; плотность 1,2506 кг/м3 (при 0°C и 101325 н/м2 или 760 мм рт. ст.), tпл -209,86°C, tкип -195,8?C. А. сжижается с трудом: его критическая температура довольно низка (-147,1 °C), а критическое давление высоко 3,39 Мн/м2 (34,6 кгс/см2); плотность жидкого азота 808 кг{м3. В воде азот менее растворим, чем кислород: при 0°C в 1 м3 Н2О растворяется 23,3 г азота. Лучше, чем в воде, азот растворим в некоторых углеводородах. Только с такими активными металлами, как литий, кальций, магний, азот взаимодействует при нагревании до сравнительно невысоких температур. С большинством других элементов азот реагирует при высокой температуре и в присутствии катализаторов. Хорошо изучены соединения азота с кислородом N2O, NO, N2O3, NO2 и N2O5. Из них при непосредственном взаимодействии элементов (4000оC) образуется окись NO, которая при охлаждении легко окисляется далее до двуокиси NO2. В воздухе окислы азота образуются при атмосферных разрядах. Их можно получить также действием на смесь азота с кислородом ионизирующих излучений. При растворении в воде азотистого N2О3 и азотного N2О5 ангидридов соответственно получаются азотистая кислота HNO2 и азотная кислота HNO3, образующие соли - нитриты и нитраты. С водородом азот соединяется только при высокой температуре и в присутствии катализаторов, при этом образуется аммиак NH3. Кроме аммиака, известны и другие многочисленные соединения азота с водородом, например гидразин H2N-NH2, диимид HN-NH, азотистоводородная кислота HN3(H-N-NºN), октазон N8H14 и др.; большинство соединений азота с водородом выделено только в виде органических производных. С галогенами азот непосредственно не взаимодействует, поэтому все галогениды азот получают только косвенным путём, например фтористый азот NF3- при взаимодействии фтора с аммиаком. Как правило, галогениды азота - малостойкие соединения (за исключением NF3); более устойчивы оксигалогениды азота - NOF, NOCI, NOBr, N02F и NO2CI. С серой также не происходит непосредственного соединения азота; азотистая сера N4S4 получается в результате реакции жидкой серы с аммиаком. При взаимодействии раскалённого кокса с азотом образуется циан (CN).;. Нагреванием азота с ацетиленом C2H2 до 1500оC может быть получен цианистый водород HCN. Взаимодействие азота с металлами при высоких температурах приводит к образованию нитридов (например, Mg3N2). Группой
называется совокупность элементов с одинаковой валентностью по кислороду. Эта высшая валентность определяется номером группы. Так как сумма высших валентностей по кислороду для элементов-неметаллов равна восьми, то по номеру группы легко определить и формулу высшего водородного соединения. Так, для фосфора
- элемента пятой группы - высшая валентность по кислороду равна пяти, формула высшего окисла Р2О5, а формула соединения с водородом - РН3. Для серы - элемента шестой группы - формула высшего окисла - SO3, а высшего соединения с водородом - H2S.
Следует учесть, что некоторые главные подгруппы также отличаются друг от друга по строению атомов их элементов. Исходя из этого, все подгруппы периодической системы можно разделить на 4
категории
. Состав периодов.
Число элементов в любом периоде выражается формулой 2п2 где n - целое число. Во 2 и 3 периодах находится по 8 элементов; в 4 и 5 - по 18 элементов; в 6-32 элемента; в 7, еще не законченном, пока 18, элементов, хотя теоретически должно быть тоже 32 элемента. Различный количественный состав периодов приводит к важному следствию: соседние элементы малых периодов , например углерод С и азот N сравнительно резко отличаются друг от друга по своим свойствам: соседние же элементы больших периодов, например, свинец Pb и висмут Bi, значительно ближе по свойствам друг к другу, так как изменение характера элементов в больших периодах происходит малыми скачками. На отдельных участках больших периодов наблюдается даже столь медленный спад металличности, что рядом стоящие элементы оказываются весьма сходными по своим химический свойствам. Такова, например, триада элементов четвертого периода: железо Fe – кобальт Со – никель Ni, которую часто называют «семейством железа». Сходство по горизонтали (горизонтальная аналогия) перекрывает здесь даже сходство по вертикали (вертикальную аналогию); так, элементы подгруппы железа - железо, рутений, осмий-менее химически сходны между собой, чем элементы «семейства железа». Расположение элементов в периодической системе. Закон Мозли.
Д. И. Менделеев расположил элементы в определенной последовательности, называемой иногда „Менделеевским рядом". В целом эта последовательность (нумерация) связана с возрастанием атомных масс элементов. Однако имеются и исключения. Иногда логичный ход изменения валентности находится в противоречии с ходом изменения атомных масс. В таких случаях необходимость требовала отдать предпочтение какой-либо одной из этих двух основ систематизации. Д. И. Менделеев в отдельных случаях нарушал принцип расположения элементов но возрастающим атомным массам и опирался на химическую аналогию между элементами. Если бы Менделеев поместил никель Ni перед кобальтом Со, йод I перед теллуром Те, то эти элементы попали бы в подгруппы и группы, не соответствующие, их свойствам, и их высшей валентности. После работ Г. Мозли атомная масса элемента постепенно начала уступать свою первенствующую роль новой, еще не ясной по своему внутреннему (физическому) смыслу, но более четкой константе - порядковому или, как теперь называют, атомному номеру элемента. Физический смысл этой константы был выявлен в 1920 г. работами английского ученого Д.Чедвика. Д. Чёдвик экспериментально установил, что порядковый номер элемента численно равен величине положительного заряда Z ядра атома этого элемента, т. е. количеству протонов в ядре. Оказалось, что Д. И. Менделеев, сам того не подозревая, расставил элементы в последовательности , точно соответствующей возрастанию заряда ядер их атомов. Периодическая система и строение электронных оболочек атомов элементов.
В дальнейшем было установлено, что не только порядковый номер элемента имеет глубокий физический смысл, но и другие понятия, ранее рассмотренные ранее также постепенно приобретали физический смысл. Например, номер группы , указывая на высшую валентность элемента, выявляет тем самым максимальное число электронов атома того или иного элемента, которое может участвовать в образовании химической связи. Выведенную формулу можно, разумеется, и упростить , в распределение электронов лишь по энергетическим уровням: Zr – 2|8| 18 |8 + 2| 2 (стрелкой указано место вступления очередного электрона; подчеркнуты валентные электроны). Физический смысл категории подгрупп заключается не только в различии места вступления очередного электрона в оболочку атома, но и в том, на каких уровнях расположены валентные электроны. Из сопоставления упрощенных электронных формул, например, хлора (3-й период, главная подгруппа VII группы), циркония (5-й период, побочная подгруппа IV группы) и урана (7-й период, подгруппа лантаноидно-актиноидная) Свойства элементов. Энергия ионизации. Энергия сродства к электрону.
Сравнительное рассмотрение свойств элементов осуществляется по трем возможным направлениям периодической системы: а) горизонтальному (по периоду), б) вертикальному (по подгруппе), в) диагональному. Для упрощения рассуждений исключим 1-й период, незаконченный 7-й, а также всю VIII группу. Останется основной параллелограмм системы, в верхнем левом углу которого будет находится литий Li (№3), в нижнем левом – цезий Сs (№55). В правом верхнем – фтор F (№9), в правом нижнем – астат Аt (№85). Чем меньше эта энергия, тем атом элемента сильнее проявляет восстановительные свойства, тем элемент металличнее; чем больше этa энергия , тем металлические свойства слабее, тем сильнее у элемента проявляются неметаллические свойства. Свойство атома любого элемента принимать электрон и превращаться при этом в отрицательно заряженный ион оценивается количеством выделяющейся энергии, называемой энергичней сродства к электрону Е; ее также выражают в ккал/г-атом или кдж/г-атом. Сродство к электрону может служить мерой способности элемента проявлять неметаллические свойства. Чем больше эта энергия, тем элемент неметалличнее, и, наоборот, чем энергия меньше, тем элемент металличнее. График изменения эдектроотрицательностн элементов главных подгрупп I-VII групп.
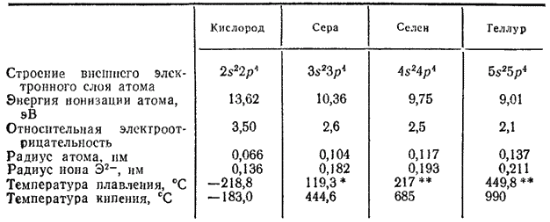
Периодический закон и периодическая система элементов имеют огромное философское, научное и методологическое значения. Они являются: средством познания окружающего нас мира. Периодический закон вскрывает и отражает диалектико-материалистическую сущность природы. Периодический, закон и периодическая система элементов со всей убедительностью доказывают единство и материальность окружающего нас мира. Они являются лучшим подтверждением справедливости основных черт марксистского диалектического метода познания: а) взаимосвязи и взаимозависимости предметов и явлений, б) непрерывности движения и развития, в) перехода количественных изменений в качественные, г) борьбы и единства противоположностей. Элементы главной подгруппы шестой группы периодической системы это кислород, сера, селен, теллур и полоний. Последний из них - радиоактивный металл; известны как природные, так и искусственно полученные его изотопы. Во внешней электронной оболочке атомы рассматриваемых элементов содержат шесть электронов - два на -орбитали и четыре на р-орбитали. Атом кислорода отличается от атомов других элементов подгруппы отсутствием -подуровня во внешнем электронном слое: Как указывалось в § 41, такая электронная структура атома кислорода обусловливает большие энергетические затраты на «распаривание» его электронов, не компенсируемые энергией образования новых ковалентных связей. Поэтому ковалентность кислорода, как правило, равна двум. Однако в некоторых случаях атом кислорода, обладающий неподеленнымн электронными парами, может выступать в качестве донора электронов и образовывать дополнительные ковалентные связи по донорно-акцепторному способу. У серы и у остальных элементов подгруппы число неспаренных электронов в атоме может быть увеличено путем перевода s- и р-электронов на -подуровень внешнего слоя. В связи с этим указанные элементы проявляют ковалентность, равную не только 2, но также 4 и 6. Все элементы данной подгруппы, кроме полония, неметаллы, хотя и менее активные, чем галогены. В своих соединениях они проявляют как отрицательную, так и положительную окисленность. В соединениях с металлами и с водородом их степень окисленности, как правило, равна -2. В соединениях с неметаллами, например с кислородом, она может иметь значение или . Исключение при этом составляет сам кислород. По величине электроотрицательности он уступает только фтору (см. табл. 6 на стр. 118); поэтому только в соединении с этим элементом его окисленность положительна . В соединениях со всеми другими элементами окисленность кислорода отрицательна и обычно равна -2. В пероксиде водорода и его производных (см. § 117) она равна -1. Как и в группе галогенов, физические и химические свойства рассматриваемых элементов закономерно изменяются с увеличением порядкового номера. Появление новых электронных слоев влечет за собой увеличение радиусов атомов, уменьшение электроотрицательности, понижение окислительной активности незаряженных атомов и усиление восстановительных свойств атомов со степенью окисленности -2. Таблица 25. Некоторые свойства кислорода и его аналогов Поэтому неметаллические свойства, ярко выраженные у кислорода, оказываются очень ослабленными у теллура. Некоторые свойства элементов главной подгруппы шестой группы приведены в табл. 25.Периоди ческая система химических элементов
- это графическое выражение периодического закона.
Некоторые элементы имеют высшую валентность, не равную номеру их групп. Такими исключениями являются медь Сu, серебро Ag, золото Аu
. Они находятся в первой группе, однако их валентности изменяются от 1 до 3. Например, имеются соединения: CuO; AgO; Cu2O3; Au2О3. Кислород
поставлен в шестую группу, хотя соединения его с валентностью выше двух почти не встречаются. Фтор Р - элемент VII группы - в своих важнейших соединениях одновалентен; бром Вr -элемент VII группы - максимально пятивалентен. Особенно много исключений в VIII группе. В ней только два элемента: рутений Ru и осмий Os проявляют валентность, равную восьми , их высшие окислы имеют формулы RuO4 и OsO4 Валентность же остальных элементов VIII группы значительно ниже.
Элементы группы распределяются по подгруппам
. Подгруппа объединяет элементы данной группы, более сходные по своим химическим свойствам. Сходство это зависит от аналогии в строении электронных оболочек атомов элементов. В периодической системе символы элементов каждой из подгрупп располагают строго по вертикали.
В первых семи группах имеется по одной главной и по одной побочной подгруппе; в восьмой группе имеется одна главная подгруппа, «инертные» элементы, и три побочных. Наименование каждой подгруппы обычно дается по названию верхнего элемента, например: подгруппа лития (Li-Na-K-Rb-Cs-Fr),
подгруппа хрома (Cr-Mo-W).В то время как элементы одной и той же подгруппы являются химическими аналогам, элементы разных подгрупп одной и той же группы иногда очень резко отличаются по своим свойствам. Общим свойством для элементов главной и побочной подгрупп одной и, той же группы является в основном только одинаковая их высшая валентность по кислороду. Так, марганец Мn и хлор С1, находящиеся в разных подгруппах VII группы, химически не имеют почти ничего общего: марганец - металл, хлор - типичный неметалл. Однако формулы их высших оксидов и отвечающие им гидроокиси аналогичны: Мn2О7 - Cl2O7; НМnО4 - НС1О4.
В периодической системе имеются два горизонтальных ряда по 14 элементов, расположенных вне групп. Обычно их помещают внизу таблицы. Один из этих рядов составляют элементы, названные лантаноидами (буквально: подобные лантану), другой ряд - элементы актиноиды (подобные актинию). Символы актиноидов расположены под символами лантаноидов. Этим расположением выявляются 14 более коротких подгрупп , состоящих из 2 элементов каждая: это вторые побочные, или лантаноидно-актиноидные подгруппы.
На основе всего сказанного различают: а) главные подгруппы, б) побочные подгруппы и в) вторые побочные (лантаноидно-актиноидные) подгруппы.
I. Главные подгруппы I и II групп (подгруппы лития и бериллия).
II. Шесть главных подгрупп III - IV - V - VI - VII - VIII групп (подгруппы бора, углерода, азота, кислорода, фтора и неона).
III. Десять побочных подгрупп (по одной в I - VII группах и три в VIII группе). Jfc,
IV. Четырнадцать лантаноидно-актиноидных подгрупп.
Количества подгрупп этих 4-х категорий составляют арифметическую прогрессию: 2-6-10-14.
Следует отметить, что верхней элемент любой главной подгруппы находится во 2 периоде; верхний элемент любой побочной - в 4 периоде; верхний элемент любой лантаноидно-актиноидной подгруппы - в 6 периоде. Таким образом, с каждым новым четным периодом периодической системы появляются новые категории подгрупп.
Каждый элемент, кроме нахождения в той или иной группе и подгруппе, находится, еще в одном из семи периодов.
Периодом называется такая последовательность элементов, на протяжении которой свойства их изменяются в порядке постепенного усиления от типично металлических до типично неметаллических (металлоидных). Заканчивается каждый период инертным элементом. По мере ослабления металлических свойств у элементов начинают появляться и постепенно усиливаются неметаллические свойства ; в середине периодов находятся обычно элементы, совмещающие в той или иной степени как металлические, так и неметаллические свойства. Эти элементы часто называют амфотерными.
Периоды не равномерны по числу входящих в них элементов. Первые три называются малыми
, остальные четыре - большими
.
Оригинален 1 период. В нем только два элемента: водород Н и гелий Не. Переход свойств от металлических до неметаллических совершается:здесь в одном типично амфотерном элементе - водороде. Последний по присущим ему некоторым металлическим свойствам возглавляет подгруппу щелочных
металлов, по присущим же ему неметаллическим свойствам - подгруппу галогенов
. Водород поэтому часто помещают в периодической системе дважды - в 1 и VII группах.
Наиболее ярким примером горизонтальной аналогии являются лантаноиды. Все они химически сходны между собой и с лантаном La. В природе они встречаются компаниями, трудно разделяются, типичная высшая валентность большинства их равна 3. У лантаноидов обнаружена особая внутренняя периодичность: каждый восьмой из них по порядку расположения повторяет в некоторой степени свойства и валентные состояния первого, т.е. того из них , от которого начинается отсчет. Так, тербий Тb похож на церий Се; лютеций Lu - на гадолиний Gd.
Актиноиды сходны с лантаноидами, однако горизонтальная аналогия у них проявляется в значительно меньшей степени. Высшая валентность некоторых актиноидов (например, урана U) достигает шести. Принципиально возможная и среди них внутренняя периодичность пока еще не подтверждена.
В 1913 г. английский ученый Г. Мозли, исследуя спектры лучей Рентгена для различных элементов, подметил закономерность, связывающую номера элементов в периодической системе Менделеева с длиной волн этих лучей, получившихся в результате облучения тех или иных элементов катодными тучами. Оказалось , что квадратные корни из обратных значений длин волн этих лучей связаны линейной зависимостью с порядковыми номерами соответствующих элементов. Закон Г. Мозли позволил проверить правильность „Менделеевского ряда" и подтвердил его безупречности.
Пусть, например, известны значения для элементов № 20 и №30, номера которых в системе сомнений у нас не вызывают. Эти значения связаны с указанными номерами линейной зависимостью. Для проверки, например, правильности номера, присвоенного кобальту (27), и судя по атомной массе, этот номер должен был бы иметь никель, его облучают катодными лучами: в результате из кобальта выделяются лучи Рентгена. Разложением их на подходящих дифракционных решетках (на кристаллах) получаем спектр этих лучей и, выбрав наиболее четкую из спектральных линий, измеряем длину волны () луча, соответствующего этой линии; затем откладываем на ординате значение . Из полученной точки А проводим прямую, параллельную оси абсцисс, до пересечения с выявленной ранее прямой. Из точки пересечения Б опускаем перпендикуляр на ось абсцисс: он точно укажет нам номер кобальта, равный 27. Современная формулировка периодического закона. Физический смысл порядкового номера элемента.
К этому же времени было также установлено, что атомы одного и того же элемента могут отличаться друг от друга своей массой; такие атомы получили название изотопов. Примером могут служить атомы: и . В периодической системе изотопы одного и того же элемента занимают одну клетку. В связи с открытием изотопов было уточнено понятие химический элемент. В настоящее время химическим элементом называют вид атомов, имеющих одинаковый заряд ядра - одинаковое количество протонов в ядре. Была уточнена и формулировка периодического закона. Современная формулировка закона гласит: свойства элементов и их соединений находятся в периодической зависимости от величины, заряда ядер их атомов.
Периодически изменяются и другие характеристики элементов, связанные со строением внешних электронных слоев атомов, атомные объемы, энергия ионизации и другие свойства.
Номер периода, в свою очередь, оказался связанным с числом энергетических уровней, имеющихся в электронной оболочке атома элемента данного периода.
Таким образом, например, „координаты" олова Sn (порядковый номер 50, 5 период, главная подгруппа IV группы), означают, что электронов в атоме олова 50, распределены они на 5 энергетических уровнях, валентными являются лишь 4 электрона.
Физический смысл нахождения элементов в подгруппах различных категорий чрезвычайно важен. Оказывается, что у элементов, расположенных в подгруппах I категории, очередной (последний) электрон располагается на s-подуровне внешнего уровня. Эти элементы относят к электронному семейству. У атомов элементов, расположенных в подгруппах II категории , очередной электрон располагается на р-подуровне внешнего уровня. Это, элементы электронного семейства „р". Так, очередной 50-й электрон у атомов олова располагается на р-подуровне внешнего , т. е. 5-го энергетического уровня.
У атомов элементов подгрупп III категории очередной электрон располагается на d-подуровне, но уже пред внешнего уровня, это элементы электронного семейства «d». У атомов лантаноидов и актиноидов очередной электрон располагается на f-подуровне, пред пред внешнего уровня. Это элементы электронного семейства «f».
Не случайно, следовательно, отмеченные выше числа подгрупп этих 4-х категорий, то есть 2-6-10-14, совпадают с максимальными числами электронов на подуровнях s-p-d-f.
Но можно, оказывается, решить вопрос о порядке заполнения электронной оболочки и вывести электронную формулу для атома любого элемента и на основе периодической системы, которая с достаточной ясностью указывает уровень и подуровень каждого очередного электрона. Периодическая система указывает и на размещение одного за другим элементов по периодам, группам, подгруппам и на распределение их электронов по уровням и подуровням, потому что каждому элементу соответствует свой собственный , характеризующий его последний электрон. В качестве примера разберем составление электронной формулы для атома элемента циркония (Zr). Периодическая система дает показатели и „координаты" этого элемента: порядковый номер 40, период 5, группа IV, побочная подгруппа. Первые выводы: а) всех электронов 40, б) эти 40 электронов распределены на пяти энергетических уровнях; в) из 40 электронов только 4 являются валентными, г) очередной 40-й электрон поступил на d-подуровень пред внешнего, т. е. четвертого энергетического уровня. Подобные выводы можно сделать о каждом из 39 элементов, предшествующих цирконию, только показатели и координаты будут каждый раз иными.
Поэтому методический прием составления электронных формул элементов на основе периодической системы и состоит в том, что мы последовательно рассматриваем электронные оболочка каждого элемента по пути к заданному, выявляя по его «координатам", куда направился в оболочке его очередной электрон.
Первые два элемента первого периода водород Н и гелий Не относятся к s-семейству. Их электроны в числе двух поступают на s-подуровень первого уровня. Записываем: Певый период на этом заканчивается, первый энергетический уровень также. Следующие по порядку два элемента второго периода - литий Li и бериллий Be находятся в главных подгруппах I и II групп. Это также s-элементы. Их очередные электроны расположатся на s подуровне 2-го уровня. Записываем Далее следуют подряд 6 элементов 2-го периода: бор В, углерод С, азот N, кислород О , фтор F и неон Ne. Согласно местонахождению этих элементов в главных подгруппах Ш - Vl групп их очередные электроны в числе шести будут располагаться на р-подуровне 2-го уровня. Записываем: Инертным элементом неоном второй период заканчивается, второй энергетический уровень также закончен. Далее следуют два элемента третьего периода главных подгрупп I и II групп: натрий Na и магний Mg. Это s-элементы и их очередные электроны располагаются на s-подуровне 3-го уровня Затем идут шесть элементов 3-го периода: алюминий Аl, кремний Si, фосфор Р, сера S, хлор С1, аргон Аr. Согласно нахождению этих элементов в главных подгруппах III - УI групп их очередные электроны в числе шести расположатся на р-подуровне 3-го уровня - Инертным элементом аргоном 3-й период закончен, но 3-й энергетический уровень еще не закончен, пока отсутствуют электроны на его третьем возможном d-подуровне.
Далее следуют 2 элемента 4-го периода главных подгрупп I и II групп: калий К и кальций Са. Это снова s-элементы. Их очередные электроны будут находиться на s-подуровне, но уже 4-го уровня. Этим очередным электронам энергетически выгоднее начать заполнять более удаленный от ядра 4-й уровень, нежели заполнять подуровень 3d. Записываем: Десять следующих элементов 4-го периода от № 21 скандия Sc до № 30 цинка Zn находятся в побочных подгруппах III - V - VI - VII - VIII - I - II групп. Так как все они являются d-элементами, то их очередные электроны располагаются на d-подуровне пред внешнего уровня т. е. третьего от ядра. Записываем:
Следующие шесть элементов 4-го периода: галлий Ga, германий Ge, мышьяк As, селен Se, бром Вr, криптон Кr - находятся в главных подгруппах III - VIIJ групп. Их очередные 6 электронов располагаются на р-подуровне внешнего, т. е. 4-го уровня: Рассмотрены 3б элементов; четвертый период закончен инертным элементом криптоном; закончен и 3-й энергетический уровень. Однако на 4 уровне полностью заполнены лишь два подуровня: s и р (из 4-х. возможных).
Далее следуют 2 элемента 5-го периода главных подгрупп I и II групп: № 37 рубидий Rb и № 38 стронций Sr. Это элементы s-семейства, и их очередные электроны располагаются на s-подуровне 5-го уровня: Последние 2 элемента - № 39 иттрий YU № 40 цирконий Zr - находятся уже в побочных подгруппах, т. е. принадлежат к d-семейству. Два их очередных электрона направятся на, d-подуровень, пред внешнего, т.е. 4-го уровня Суммируя последовательно все записи, составляем электронную формулу для атома циркония № 40 Выведенную электронную формулу для атома циркония можно несколько видоизменить, расположив подуровни в порядке нумерации их уровней:
№17, С1-2|8|7
№40, Zr - 2|8|18|8+ 2| 2
№92, U - 2|8|18 | 32 |18 + 3|8 + 1|2
видно, что у элементов любой главной подгруппы валентными могут быть лишь электроны внешнего уровня (s и р). У элементов побочных подгрупп валентными могут быть электроны внешнего и частично пред внешнего уровня (s и d). У лантаноидов и особенно актиноидов валентные электроны могут находиться на трех уровнях: внешнем, пред внешнем и пред пред внешнем. Как правило, общее число валентных электронов равно номеру группы.
направлениям. По горизонтальному направлению слева направо объемы, атомов постепенно уменьшаются; происходит, это в результате влияния увеличения заряда ядра на электронную оболочку. По вертикальному направлению сверху вниз в результате увеличения числа уровней объемы атомов постепенно возрастают; по диагональному направлению - значительно менее отчетливо выраженному и более короткому - остаются близкими. Это общие закономерности , из которых, как всегда, имеются и исключения.
В главных подгруппах по мере увеличения объемов атомов, т. е. сверху вниз, облегчается отщепление внешних электронов и затрудняется присоединение к атомам новых электронов. Отдача электронов характеризует так называемую восстановительную способность элементов, особенно типичную для металлов
. Присоединение же электронов характеризует окислительную способность, - типичную для неметаллов. Следовательно, сверху вниз в главных подгруппах восстановительная способность атомов элементов возрастает
; увеличиваются и металлические свойства простых тел, соответствующих этим элементам. Окислительная же способность уменьшается.
Слева направо по периодам картина изменений противоположная: восстановительная способность атомов элементов уменьшается, окислительная же - увеличивается ; увеличиваются неметаллические свойства простых тел, соответствующих этим элементам.
По диагональному направлению свойства элементов остается более или менее близкими. Рассмотрим это направление на примере: бериллий-алюминий
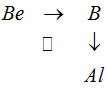 От бериллия Be к алюминию Al можно перейти непосредственно по диагонали Ве → А1, можно и через бор В, т. е. по двум катетам Be → В и В → А1. Усиление неметаллических свойств от бериллия к бору и ослабление их от бора к алюминию объясняет, почему элементы бериллий и алюминий, расположенные по диагонали, имеют некоторую аналогию в свойствах, хотя они и не стоят в одной подгруппе периодической системы.
От бериллия Be к алюминию Al можно перейти непосредственно по диагонали Ве → А1, можно и через бор В, т. е. по двум катетам Be → В и В → А1. Усиление неметаллических свойств от бериллия к бору и ослабление их от бора к алюминию объясняет, почему элементы бериллий и алюминий, расположенные по диагонали, имеют некоторую аналогию в свойствах, хотя они и не стоят в одной подгруппе периодической системы.
Таким образом, между периодической системой, строением атомов элементов и их химическими свойствами существует тесная связь.
Свойства атома любого элемента - отдавать электрон и превращаться в положительно заряженный ион - оцениваются количественно затратой энергии, называемой энергией ионизации I*. Ее выражают в ккал/г-атом или хдж/г-атом.
![]()
![]()
Часто для характеристики свойств элементов используют величину, которая называется электроотрицательностью
.
Она: представляет собой арифметическую сумму величин энергии ионизации и энергии сродства к электрону
Константа является мерой неметалличности элементов. Чем она больше, тем сильнее элемент проявляет неметаллические свойства.
Следует учитывать , что все элементы по сути дела двойственны по природе. Деление элементов на металлы и неметаллы до известной степени условно, ибо в природе нет резких граней. С усилением у элемента металлических свойств происходит ослабление его неметаглических свойств и наоборот. Самый „металличный" из элементов - франций Fr - можно считать наименее неметалличным, самый „неметалличный" - фтор F - можно считать наименее металличным.
Суммируя значения вычисленных энергий - энергии ионизации и энергии сродства к электрону, - мы получим: для цезия величину 90 ккал/г-а., для лития 128 ккал\г-а., для фтора = 510 ккал1г-а. (величину выражают и в кдж/г-а.). Это - абсолютные значения электроотрицательности. Для упрощения пользуются относительными значениями электроотрицательности, принимая электроотрицательность лития (128) за единицу. Тогда для фтора (F) получим: 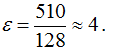
Для цезия (Cs) относительная электроотрицательность будет равна
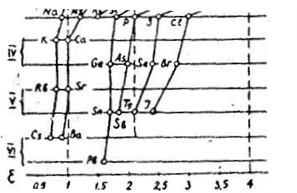
На графике изменения электроотрицательности элементов главных подгрупп
I-VII групп. сопоставлены электроотрицательности элементов главных подгрупп I-VII групп. Приведенные данные указывают на истинное положение водорода в 1-ом периоде; неодинаковое возрастание металличности элементов, сверху вниз по различным подгруппам; некоторое сходство элементов: водорода - фосфора - теллура ( = 2,1), бериллия и алюминия (=1,5) и ряда других элементов. Как видно из приведенных сопоставлений , используя значения электроотрицательности, можно приближенно сравнивать между собой, элементы даже разных подгрупп, и разных периодов.
Значения электроотрицательности
Группа
I A
II A
III B
IV B
V B
VI B
VII B
VIII B
VIII B
VIII B
I B
II B
III A
IV A
V A
VI A
VII A
VIII A
Период
1
H
2.0
He
4.5
2
Li
0.98
Be
1.57
B
2.04
C
2.55
N
3.2
O
3.44
F
3.98
Ne
4.4
3
Na
0.93
Mg
1.31
Al
1.61
Si
1.6
P
2.49
S
2.58
Cl
3.0
Ar
4.3
4
K
0.82
Ca
1.00
Sc
1.36
Ti
1.54
V
1.63
Cr
1.66
Mn
1.55
Fe
1.83
Co
1.88
Ni
1.91
Cu
1.90
Zn
1.65
Ga
1.81
Ge
2.01
As
2.4
Se
2.55
Br
2.96
Kr
3.00
5
Rb
0.82
Sr
0.95
Y
1.22
Zr
1.33
Nb
1.6
Mo
2.16
Tc
1.9
Ru
2.2
Rh
2.28
Pd
2.20
Ag
1.93
Cd
1.69
In
1.78
Sn
1.96
Sb
2.21
Te
2.4
I
2.66
Xe
2.60
6
Cs
0.79
Ba
0.89
*
Hf
1.3
Ta
1.5
W
2.36
Re
1.9
Os
2.2
Ir
2.20
Pt
2.28
Au
2.64
Hg
2.2
Tl
1.62
Pb
2.33
Bi
2.02
Po
2.3
At
2.5
Rn
2.2
7
Fr
0.8
Ra
0.9
**
Rf
Db
Sg
Bh
Hs
Mt
Ds
Rg
Cn
Uut
Uuq
Uup
Uuh
Uus
Uuo
Лантаноиды
*
La
1.1
Ce
1.12
Pr
1.13
Nd
1.14
Pm
1.13
Sm
1.17
Eu
1.2
Gd
1.2
Tb
1.1
Dy
1.22
Ho
1.23
Er
1.24
Tm
1.25
Yb
1.1
Lu
1.27
Актиноиды
**
Ac
1.1
Th
1.3
Pa
1.5
U
1.38
Np
1.36
Pu
1.28
Am
1.13
Cm
1.28
Bk
1.3
Cf
1.3
Es
1.3
Fm
1.3
Md
1.3
No
1.3
Lr
1.291